УДК 6l4.7i|347.415.3]-074
АНАЛИЗ ЭТИЛЕНИМИНА В ВОЗДУХЕ
Г. С. Салямон, М. В. Попелковская (Ленинград)
Нами разработан метод анализа в воздухе этиленимина (ЭИ), основанный на гидролизе его до этаноламина, окислении последнего йодной кислотой и колориметрировании образовавшегося формальдегида с хромотроповой кислотой. Определяемый минимум — 0,04 мкг ЭИ в пробе.
Воздух в количестве от 10 до 100 л протягивают со скоростью 2 л!мин через 2 поглотительных прибора Рыхтера, заполненных от 2 до 5 мл 0,01 н.раствора HCl. Содержимое поглотителей объединяют или анализируют отдельно. Нагревают 2 мл испытуемой пробы 30 мин. на кипящей водяной бане. Охлаждают, прибавляют по 0,2 мл 5% раствора NaHCOs, по 0,2 мл раствора, приготовленного из 1 г НЮ4.2Н20 в 50 мл Н20 и 50 мл 5% N?HC03. Нагревают 30 мин. на водяной бане при 40°. Охлаждают, прибавляют по I мл концентрированной H2S04, осторожно встряхивают и добавляют I—2 капли 20% раствора сульфита натрия до обесцвечивания. Затем вносят по 5 мл раствора хромот-
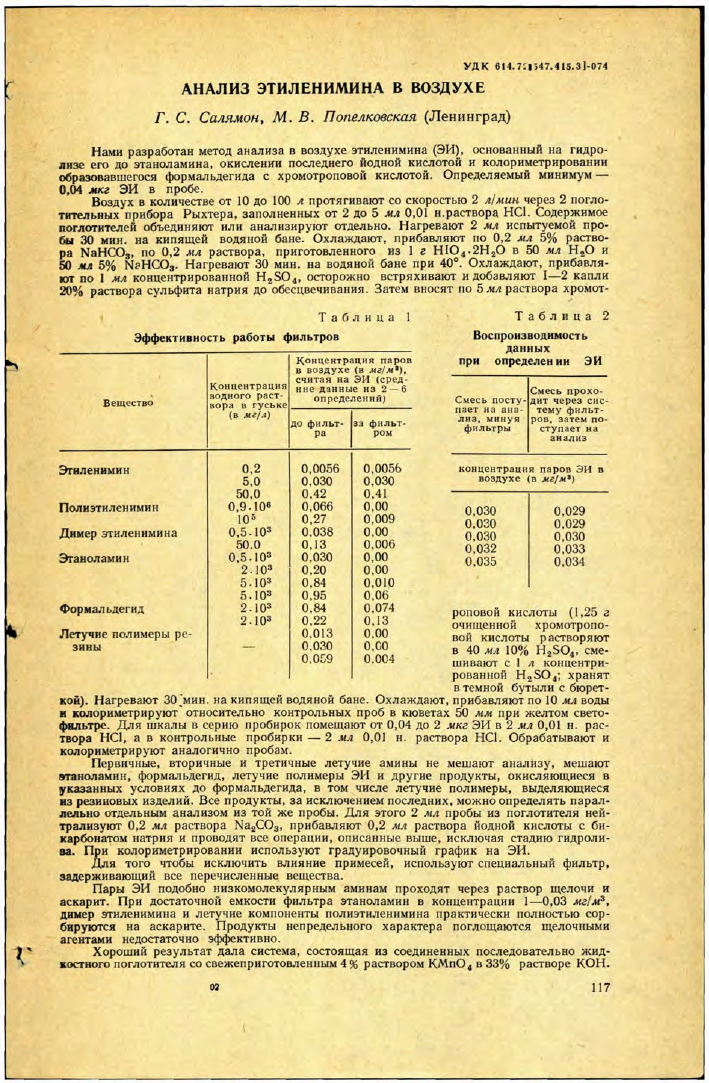
Таблица 1 Эффективность работы фильтров
Концентрация паров
в воздухе (в мг'м*),
Концентрация считая на ЭИ (сред-
нне данные из '2 — 6
Вещество водного раствора в гуське (в мг/л) определений)
до фильтра зэ фильтром
Эгиленимин 0,2 0,0056 0,0056
5,0 0,030 0,030
50,0 0,42 0,41
Полиэтиленимин 0,9.10е 0,066 0,00
105 0,27 0,009
Димер этиленимина 0,5.103 0.038 0.00
50.0 0,13 0,006
Этаноламин 0,5.103 0,030 0.00
2.103 0.20 0,00
5.103 0,84 0,010
5.103 0,95 0.06
Формал ьдегид 2.I03 0,84 0,074
2.103 0,22 0.13
Летучие полимеры ре- 0.013 0.00
зины 0.030 0,059 о.со 0.004
Таблица 1
Воспроизводимость данных при определен ии ЭИ
Смесь поступает на анализ, минуя фильтры
Смесь проходит через систему фильтров. затем поступает на анализ
концентрация паров ЭИ в воздухе (в мг/м•)
0,030 0,029
0,030 0,029
0,030 0,030
0.032 0,033
0,035 0,034
роповой кислоты (1,25 г очищенной хромотроповой кислоты растворяют в 40 мл 10% H2SO„, смешивают с 1 л концентрированной H2S04; хранят в темной бутыли с бюреткой). Нагревают 30_мин. на кипящей водяной бане. Охлаждают, прибавляют по 10 мл воды и колориметрируют относительно контрольных проб в кюветах 50 мм при желтом светофильтре. Для шкалы в серию пробирок помещают от 0,04 до 2 мкг ЭИ в 2 мл 0,01 н. раствора HCl, а в контрольные пробирки —2 мл 0,0! н. раствора HCl. Обрабатывают и колориметрируют аналогично пробам.
Первичные, вторичные и третичные летучие амины не мешают анализу, мешают этаноламин, формальдегид, летучие полимеры ЭИ и другие продукты, окисляющиеся в указанных условиях до формальдегида, в том числе летучие полимеры, выделяющиеся из резиновых изделий. Все продукты, за исключением последних, можно определять параллельно отдельным анализом из той же пробы. Для этого 2 мл пробы из поглотителя нейтрализуют 0,2 мл раствора Na2C03, прибавляют 0,2 мл раствора йодной кислоты с бикарбонатом натрия и проводят все операции, описанные выше, исключая стадию гидролиза. При колориметрировании используют градуировочный график на ЭИ.
Для того чтобы исключить влияние примесей, используют специальный фильтр, задерживающий все перечисленные вещества.
Пары ЭИ подобно низкомолекулярным аминам проходят через раствор щелочи и аскарит. При достаточной емкости фильтра этаноламин в концентрации 1—0,03 мг1м3, димер этиленимина и летучие компоненты полиэтиленимина практически полностью сорбируются на аскарите. Продукты непредельного характера поглощаются щелочными агентами недостаточно эффективно.
Хороший результат дала система, состоящая из соединенных последовательно жидкостного поглотителя со свежеприготовленным 4% раствором КМп04 в 33% растворе КОН.
га
117
Такая система поглощает практически полностью пары этаноламина, полиэтиленимина, димера ЭИ и летучие полимеры резины при концентрации этих веществ, в десятки и сотни раз превосходящей концентрацию ЭИ; формальдегид поглощается на 90—95%; пары этиленимина в системе не задерживаются (табл. 1). Точность и воспроизводимость одной из серий опытов при протягивании ЭИ через систему фильтров или минуя ее показаны в табл. 2.
Для получения воспроизводимых результатов требуются большая чистота и тщательность.
Выводы
1. Разработан метод анализа этиленимина (ЭИ) в воздухе, основанный на гидролизе его, окислении до формальдегида и колориметрировании последнего с хромотроповой кислотой. Определяемый минимум — 0,04 мкг в пробе. Продукты, мешающие анализу, могут определяться параллельно или предварительно отделяться.
2. Пары ЭИ в воздухе полностью проходят через концентрированный раствор щелочи, щелочной раствор КМп04 и аскарит. Пары этаноламина, летучих полимеров этиленимина, полиэтиленимина, формальдегида и другие примеси задерживаются в щелочном растворе и на аскарите, на основе чего разработан фильтр для очистки ЭИ в воздухе от примесей.
Поступила 26/У 1970 г.
УДК в 14.37;576.858.095.87
ДИНАМИКА ИНАКТИВАЦИИ ВИРУСОВ НА ПОВЕРХНОСТЯХ ПРИ АЭРОЗОЛЬНОМ СПОСОБЕ ИХ ИНФИЦИРОВАНИЯ
В. В. Влодавец, Р. А. Дмитриева
Институт общей и коммунальной гигиены им. А. Н. Сысина АМН СССР, Москва
Вопрос о циркуляции респираторных вирусов в помещениях имеет существенное значение в изучении механизма распространения инфекционных заболеваний. При кашле и чиханье больных крупные капли аэрозоля, содержащие основную массу выделяемого во внешнюю среду инфекционного агента, оседают на окружающие предметы. После высыхания и соединения с пылевыми частицами они могут ресуспендироваться и поступать в воздух в виде пылевой фазы аэрозоля. В случае сохранения вирусами инфекционной активности поверхности могут играть определенную роль в циркуляции вирусов в помещениях и соответственно в инфицировании восприимчивых контингентов.
Сохранение инфекционной активности различными вирусами на поверхностях практически не изучено, что, по-видимому, связано с трудностями методического характера. 3. И. Мерекаловой и А. Л. Беляевым1 исследовалась выживаемость вируса гриппа н аденовирусов на различных поверхностях. Однако инфицирование поверхностей производилось нанесением пипеткой капель вирусосодержащего материала на поверхность тест-объекта. Аэрозольный способ инфицинрования вирусами поверхностей был использован в работе Dixon и соавт.
Мы изучали выживаемость вирусов и бактериофага на распространенных в больничных помещениях хлопчатобумажной ткани, линолиуме и дереве, окрашенном масляной краской. После инфицирования чашки с тестами вынимали из камеры и хранили при комнатной температуре (18—22°) и относительной влажности в пределах 46—55%. Инфицирование поверхностей тест-объектов проводили в аэрозольной камере типа Е объемом 500 л, где устанавливали распылитель с суспензией бактериофага или вируса, а'на расстоянии 30 см от него помещали чашки Петри с тест-объектами. Чашки открывали на I1/» мин. во время распыления и оставляли открытыми еще 5 мин. после окончания его. Мелкие капли аэрозоля наносили на поверхности тест-объектов в течение^ Р/2 мин. также в камере, где на штативе на расстоянии 20, 30 и 50 см от распылителя устанавливали вертикально укрепленные тесты. Инфицирование вертикально расположенных тестов лучше всего проводить на расстоянии 30 см. Наши данные показали, что для инфицирования тестов может быть использован как? метод нанесения капель вируссодержащего материала из распылителя на вертикально расположенные поверхности, так и метод оседания. Нами было отдано предпочтение методу оседания как наиболее приближающемуся к естественному инфицированию поверхностей в непосредственном окружении больных.
В качестве моделей респираторных вирусов использованы вирусы парагриппа 3 типа, респираторно-синцитиальный, штамм Randol, аденовирусы 5 типа (эталонный и 22ф, выделенный из фекалий больных инфекционным гепатитом) и энтеровирус ЕСН07. Инфекционная активность вируссодержащих жидкостей, используемых для работы, была следующей: для вирусов парагриппа—6,5—7 lg. респираторно-синцитиального— 3—3,8 ig,
1 Автореферат кандидатской диссертации. М., 1967.





 CC BY
CC BY 9
9