| ГЕМАТОЛОГИЯ И ТРАНСФУЗИОЛОГИЯ | RUSSIAN JOURNAL OF HEMATOLOGY AND TRANSFUSIOLOGY (GEMATOLOGIYA I TRANSFUSIOLOGIYA) | 2020; ТОМ 65; №1 |
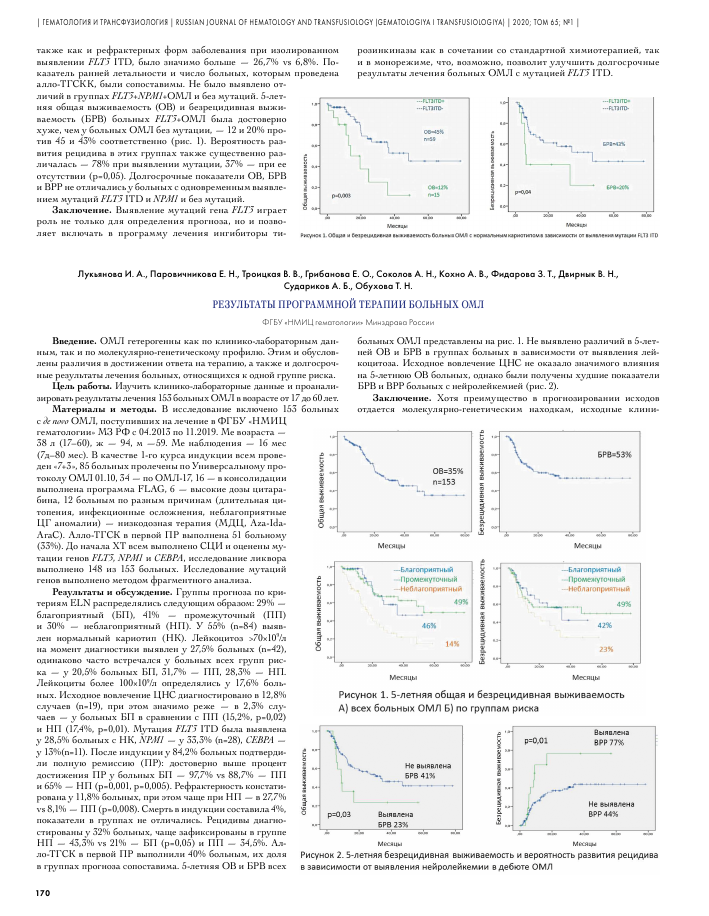
также как и рефрактерных форм заболевания при изолированном выявлении FLT3 ITD, было значимо больше — 26,7% vs 6,8%. Показатель ранней летальности и число больных, которым проведена алло-ТГСКК, были сопоставимы. Не было выявлено отличий в группах FLT3+NPM1+ОМЛ и без мутаций. 5-летняя общая выживаемость (ОВ) и безрецидивная выживаемость (БРВ) больных FLT3+ОМЛ была достоверно хуже, чем у больных ОМЛ без мутации, — 12 и 20% против 45 и 43% соответственно (рис. 1). Вероятность развития рецидива в этих группах также существенно различалась — 78% при выявлении мутации, 37% — при ее отсутствии (р=0,05). Долгосрочные показатели ОВ, БРВ и ВРР не отличались у больных с одновременным выявлением мутаций FLT3 ITD и NPM1 и без мутаций.
Заключение. Выявление мутаций гена FLT3 играет роль не только для определения прогноза, но и позволяет включать в программу лечения ингибиторы ти-
розинкиназы как в сочетании со стандартной химиотерапией, так и в монорежиме, что, возможно, позволит улучшить долгосрочные результаты лечения больных ОМЛ с мутацией FLT3 ITD.
Лукьянова И. А., Паровичникова Е. Н., Троицкая В. В., Грибанова Е. О., Соколов А. Н., Кохно А. В., Фидарова З. Т., Двирнык В. Н.,
Судариков А. Б., Обухова Т. Н.
РЕЗУЛЬТАТЫ ПРОГРАММНОЙ ТЕРАПИИ БОЛЬНЫХ ОМЛ
ФГБУ «НМИЦ гематологии» Минздрава России
Введение. ОМЛ гетерогенны как по клинико-лабораторным данным, так и по молекулярно-генетическому профилю. Этим и обусловлены различия в достижении ответа на терапию, а также и долгосрочные результаты лечения больных, относящихся к одной группе риска.
Цель работы. Изучить клинико-лабораторные данные и проанализировать результаты лечения 153 больных ОМЛ в возрасте от 17 до 60 лет.
Материалы и методы. В исследование включено 153 больных с de novo ОМЛ, поступивших на лечение в ФГБУ «НМИЦ гематологии» МЗ РФ с 04.2013 по 11.2019. Ме возраста — 38 л (17—60), ж — 94, м —59. Ме наблюдения — 16 мес (7д-80 мес). В качестве 1-го курса индукции всем проведен «7+3», 85 больных пролечены по Универсальному протоколу ОМЛ 01.10, 34 — по ОМЛ-17, 16 — в консолидации выполнена программа FLAG, 6 — высокие дозы цитара-бина, 12 больным по разным причинам (длительная ци-топения, инфекционные осложнения, неблагоприятные ЦГ аномалии) — низкодозная терапия (МДЦ, Aza-Ida-AraC). Алло-ТГСК в первой ПР выполнена 51 больному (33%). До начала ХТ всем выполнено СЦИ и оценены мутации генов FLT3, NPM1 и CEBPA, исследование ликвора выполнено 148 из 153 больных. Исследование мутаций генов выполнено методом фрагментного анализа.
Результаты и обсуждение. Группы прогноза по критериям ELN распределялись следующим образом: 29% — благоприятный (БП), 41% — промежуточный (ПП) и 30% — неблагоприятный (НП). У 55% (n=84) выявлен нормальный кариотип (НК). Лейкоцитоз >70х109/л на момент диагностики выявлен у 27,5% больных (n=42), одинаково часто встречался у больных всех групп риска — у 20,5% больных БП, 31,7% — ПП, 28,3% — НП. Лейкоциты более 100х109/л определялись у 17,6% больных. Исходное вовлечение ЦНС диагностировано в 12,8% случаев (n=19), при этом значимо реже — в 2,3% случаев — у больных БП в сравнении с ПП (15,2%, р=0,02) и НП (17,4%, р=0,01). Мутация FLT3 ITD была выявлена у 28,5% больных с НК, NPM1 — у 33,3% (n=28), CEBPA — у 13%(n=11). После индукции у 84,2% больных подтвердили полную ремиссию (ПР): достоверно выше процент достижения ПР у больных БП — 97,7% vs 88,7% — ПП и 65% — НП (р=0,001, р=0,005). Рефрактерность констатирована у 11,8% больных, при этом чаще при НП — в 27,7% vs 8,1% — ПП (р=0,008). Смерть в индукции составила 4%, показатели в группах не отличались. Рецидивы диагностированы у 32% больных, чаще зафиксированы в группе
НП — 43,3% vs 21% — БП (р=0,05) и ПП — 34,5%. Ал-ло-ТГСК в первой ПР выполнили 40% больным, их доля в группах прогноза сопоставима. 5-летняя ОВ и БРВ всех
больных ОМЛ представлены на рис. 1. Не выявлено различий в 5-летней ОВ и БРВ в группах больных в зависимости от выявления лейкоцитоза. Исходное вовлечение ЦНС не оказало значимого влияния на 5-летнюю ОВ больных, однако были получены худшие показатели БРВ и ВРР больных с нейролейкемией (рис. 2).
Заключение. Хотя преимущество в прогнозировании исходов отдается молекулярно-генетическим находкам, исходные клини-
Не выявлена
БРВ 41%
р=0,03 Выявлена
БРВ 23%
Выявлена
р=0,01 ВРР77%
Г
J ВРР44%
Месяцы Месяцы
Рисунок 2. Б-летняя безрецидивная выживаемость и вероятность развития рецидива в зависимости от выявления нейролейкемии в дебюте ОМЛ
ПРИЛОЖЕНИЕ 1
ко-лабораторные параметры могут оказывать влияние на исходы заболевания и должны быль приняты во внимание при выборе тактики терапии каждого конкретного больного. Неудовлетворительные
результаты лечения ОМЛ НП подтверждают необходимость модернизации индукционных подходов, а также включение в программу терапии новых таргетных препаратов.
Луцик Н. С., Яцык Г. А., Соловьев М. В., Менделеева Л. П.
ПРИМЕНЕНИЕ МРТ ВСЕГО ТЕЛА С ДИФФУЗИОННО-ВЗВЕШЕННЫМИ ИЗОБРАЖЕНИЯМИ ДЛЯ ДИАГНОСТИКИ ПОРАЖЕНИЯ КОСТНОГО МОЗГА И ОЦЕНКИ ПРОТИВООПУХОЛЕВОГО ОТВЕТА ПОСЛЕ АУТОЛОГИЧНОЙ ТРАНСПЛАНТАЦИИ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК У БОЛЬНЫХ МНОЖЕСТВЕННОЙ МИЕЛОМОЙ
ФГБУ «НМИЦ гематологии» Минздрава России
Введение. МРТ является высокоинформативным методом исследования для определения инфильтрации костного мозга у больных множественной миеломой (ММ). Диффузионно-взвешенные изображения (ДВИ) основываются на свободном движении молекул воды. В тканях с повышенной клеточностью диффузия воды будет ограничена. Количественный анализ ДВИ осуществляется с помощью измеряемого коэффициента диффузии (ИКД).
Цель работы. Определить показатели измеряемого коэффициента диффузии в очагах поражения костного мозга у больных ММ до и после трансплантации аутологичных гемопоэтических стволовых клеток (ауто-ТГСК) и оценить диагностическую эффективность МРТ всего тела с ДВИ для оценки противоопухолевого ответа.
Материалы и методы. С февраля 2017 г. по сентябрь 2019 г. 77 больным ММ (34 М, 43 Ж, возраст от 37 до 66 лет — медиана 56 лет) было выполнено МРТ всего тела с включением в протокол сканирования ДВИ перед сбором стволовых клеток крови (СКК). 30 из них было выполнено повторное МРТ всего тела с ДВИ на +100 день после выполнения трансплантации аутологичных гемопоэтических стволовых клеток (ауто-ТГСК). Исследования проводились на МР-томографе Philips Ingenia 1,5 Тл с использованием задней встроенной катушки, передней и головной катушек. В протокол сканирования были включены импульсные последовательности T1TSE, STIR в коронарных проекциях, DWI (b=0, 500, 1000 с/мм2), T2TSE в аксиальных проекциях. Были опре-
делены показатели ИКД в 284 очагах поражения при МРТ всего тела перед сбором СКК и в 192 очагах в динамике после ауто-ТГСК. Обработка изображений проводилась на рабочей станции врача IntelliSpace Portal (Philips), с помощью инструмента ROI (Region of interest).
Результаты и обсуждение. Показатели ИКД в очагах поражения костного мозга у больных ММ перед сбором СКК варьировали от 0,9 до 2,72 х 10 ~3 мм2/с (среднее значение 1,7 х 10 _3 мм2/с). После ауто-ТГСК показатели ИКД в очагах поражения стали составлять от 0,68 до 2,36 х 10 ~3 мм2/с (среднее значение 1,42 х 10 _3 мм2/с). Определялась достоверная разница между показателями ИКД в данных группах (p=0,001). Выявленное понижение показателей ИКД в очагах поражения после ауто-ТГСК обусловлено патофизиологическими процессами, происходящими в костном мозге, а именно: восстановлением нормальной костной ткани в очагах поражения, замещением специфической опухолевой инфильтрации жировым костным мозгом, уменьшением целлюлярности. Наряду с этим после ауто-ТГСК определялось уменьшение общего количества очагов поражения костного мозга на 32%.
Заключение. После ауто-ТГСК по данным МРТ всего тела с ДВИ выявлено снижение показателей ИКД, а также уменьшение общего количества очагов поражения костного мозга, что может быть рассмотрено как дополнительный диагностический критерий хорошего противоопухолевого ответа после ауто-ТГСК у больных ММ.
Лямкина А. С., Ковынев И. Б., Перепечаева М. Л., Гришанова А. Ю., Березина О. В., Поспелова Т. И., Логвиненко Н. И.
УРОВЕНЬ ГЕНА т1Я203а ПРИ РАЗЛИЧНЫХ ФАЗАХ ХРОНИЧЕСКОГО МИЕЛОЛЕЙКОЗА (ХМЛ)
ФГБОУ ВО «Новосибирский государственный медицинский университет» Минздрава России; НИИ молекулярной биологии и биофизики СО РАН, Новосибирск, Российская Федерация
Введение. Микро-РНК играют важную роль в регуляции пролиферации, миграции опухолевых клеток и их чувствительности к химиотерапии. Исследование микро-РНК может предсказать развитие опухоли, однако прогностическая ценность этого маркера нуждается в изучении. Экспрессия miR203 в клеточных линиях солидных опухолей ингибирует пролиферацию и миграцию клеток, повышает чувствительность к апоптозу опухоли и ингибирует онкогенез in vivo. В научных работах показано, что низкая экспрессия miR203 наблюдается у пациентов с различными солидными опухолями.
Цель работы. Изучить экспрессию уровня гена miR203a в клиническом материале у пациентов с ХМЛ с различными результатами противоопухолевой терапии: с большим молекулярным ответом (БМО), полным цитогенетическим ответом (ПЦО) и в прогрессирующих фазах заболевания (в хронической фазе (ХФ) и фазе акселерации (ФА) у пациентов, резистентных к специфической терапии).
Материалы и методы. Исследована периферическая кровь, костный мозг и внеклеточные микровезикулы у 56 больных ХМЛ, получающих терапию ингибиторами тирозинкиназы в рекомендуемых терапевтических дозах. Пациенты были разделены на 3 группы: а) 28 человек в группе ХФ, БМО (M0>3,0, BCR/ABL<0,1%); б) 15 человек в группе ХФ, ПЦО (Ph+0%, M0<3,0, BCR/ABL>0,1%); в) 10 человек — резистентные к терапии в ХФ без ПЦО и в ФА. Эксперимент проводился на оборудовании Института молекулярной биологии и биофизики, центр «Протеомный анализ» (Новосибирск, Россия). Общая РНК, включая miRNA, была получена с использованием ре-
агента TRIzol (Ambion, США) в соответствии с инструкциями производителя. РНК транслировали в комплементарную ДНК с помощью miRNA-специфических праймеров структуры шпильки и обратной транскриптазы M-MuLV — RH («Биолабмикс», Россия). Уровень экспрессии miR203a был изучен методом ПЦР в реальном времени с использованием принципа TaqMan на оборудовании iCycler CFX96. В качестве внутреннего стандарта применялась малая ядерная РНК U6. Все реакции проводились в триплете. Данные были проанализированы методом 2-ACt. Статистическая обработка данных проведена с помощью программы Statistica (StatSoft, Inc., США).
Результаты и обсуждение. Уровень экспрессии гена miR203a был значительно выше (р<0,05) в микровезикулах у больных с БМО, чем у больных с прогрессией ХМЛ. При оценке результатов в группе с ПЦО были получены существенные различия между всеми изученными субстратами данной группы и группы с прогрессией ХМЛ. Не было никаких существенных различий между группой, которая достигла БМО, и больными, которые достигли ПЦО, что указывает на значительную роль в прогнозе достижения полного цитогенети-ческого ответа. Также была получена обратная корреляция между уровнем экспрессии гена miR203a в миелоцитах, лимфоцитах и плазме костного мозга (р <0,05) и тяжестью фазы ХМЛ.
Заключение. Результаты демонстрируют, что экспрессия miR203 уменьшается в зависимости от прогрессирования тяжести ХМЛ, что может привести к снижению апоптоза опухолевых клеток, увеличению миграции и устойчивости к противоопухолевой терапии.





 CC BY
CC BY 44
44