УДК633.15: 547.97
КУКУРУЗА КАК ИСТОЧНИК АНТОЦИАНОВ
М.Ю. ТРЕТЬЯКОВ, кандидат биологических наук С.А. ХОРОШИЛОВ, кандидат биологических наук, старший научный сотрудник
Белгородский НИИСХ Россельхозакадеми А.Н. СИДОРОВ, магистрант
A.Н. ЧУЛКОВ, аспирант
B.И. ДЕЙНЕКА, доктор химических наук, профессор
Л.А. ДЕЙНЕКА, кандидат химических наук, доцент Белгородский государственный национальный исследовательский университет E-mail: deineka@bsu.edu.ru
Резюме. Окраска различных частей растения краснозерной формы кукурузы, обусловлена накоплением водорастворимых антиоксидантов - антоцианов. Исследования проводили с целью определения степени и особенностей их накопления в различных частях растения краснозерной кукурузы из коллекции Белгородского НИИСХ Россельхоза-кадемии. Для идентификации антоцианов кукурузы в работе использовали метод ВЭЖХ в обращенно-фазовом варианте с диодно-матричным и масс-спектрометрическим детекторами (хроматографическая система Agilent Technologies). Состав антоцианов стебля, листьев, оберток, стержня и зерна краснозерной формы кукурузы представлен цианидин-3-глюкозидом и его малонированными производными. Уровень накопления определяется органами локализации биосинтеза, наибольшее содержание отмечено для вегетативных органов: листьев, стебля и оберток - от 2500 до 4000 мг на 100 г, что обусловлено физиологической ролью этого класса соединений. Уровень накопления антоцианов краснозерной формой кукурузы в 2,5-4 раза выше, чем в традиционном сырье (плоды черники, бузины и аронии), что позволяет рассматривать ее, как перспективный источник антоциановых красителей из не пищевого сырья.
Ключевые слова: кукуруза, ВЭЖХ, антоцианы.
Кукуруза (Zea mays L.) - ценное пищевое и техническое растение, почти все части которого используются в различных отраслях промышленности. Среди прочих полезных соединений, синтезируемых этим растением, можно выделить ксантофиллы - лютеин и зеаксантин, накоплением которых обусловлена желтая окраска зерна [1, 2]. Эти два каротиноида принципиально важны для предупреждения возрастной макулярной дегенерации [2, 3].
Кроме того, известны краснозерные формы куку-рузы,внимание к которым, к сожалению, не столь велико.
В России их используют в основном в генетических исследованиях. Однако еще в перуанских Андах древние цивилизации использовали пурпурную кукурузу для получения красителя, а старинный напиток «chicha morado», насыщенный цвет которого обусловлен рекордным накоплением ан-тоцианов, популяризируется сегодня во всем мире [4]. В этом направлении можно отметить патент на способ получения натурального краси-
теля из гибридной формы кукурузы обыкновенной Zea mays L., имеющей доминантные гены маркера с рабочим названием «коричневый Саратовский», выведенной в Саратовском государственном университете [5].
Красная окраска различных частей растений краснозерных форм кукурузы, обусловлена накоплением очень важного класса природных водорастворимых антиоксидантов - антоцианов, исследованию которых с использованием методов масс-спектроскопии и высокоэффективной жидкостной хроматографии (ВЭЖХ) посвящен ряд работ зарубежных ученых [6.. .11]. По приведенным в этих публикациях данным индивидуальный состав антоцианового комплекса неодинаков для различных форм краснозерной кукурузы, а уровень их накопления зависит от условий выращивания [7]. Сведений по используемым в России формам мы не обнаружили. Поэтому цель нашего исследования - определение степени и особенностей накопления антоцианов в различных частях растения краснозерной кукурузы из коллекции Белгородского НИИСХ Россельхозакадемии.
Условия, материалы и методы. Для исследования использовали форму кукурузы известную под названием «генетический маркер Чейза», выращенную на опытном участке Белгородского НИИСХ Россельхозакадемии в 2012 г.
Экстракцию антоцианов из стебля, листьев, оберток, стержня и зерна проводили водным 0,1 М раствором соляной кислоты. Количественное содержание антоцианов определяли в пересчете на цианидин-3-глюкозид дифференциальным спектрофотометрическим методом [12].
Для идентификации антоцианов кукурузы в работе использовали метод ВЭЖХ в обращенно-фазовом варианте с диодно-матричным и масс-спектрометрическим детекторами (хроматографическая система Agilent Technologies). Состав подвижной фазы - ацетонитрил : муравьиная кислота : вода (10:10:90 об.), скорость ее подачи 1 мл/мин. Разделение компонентов проводили на хроматографической колонке Symmetry С18 4.6х 250 мм с термостатированием при 40°С. Перед хроматографированием образцы экстрактов очищали на концентрирующих патронах ДИАПАК С18. Масс-спектры
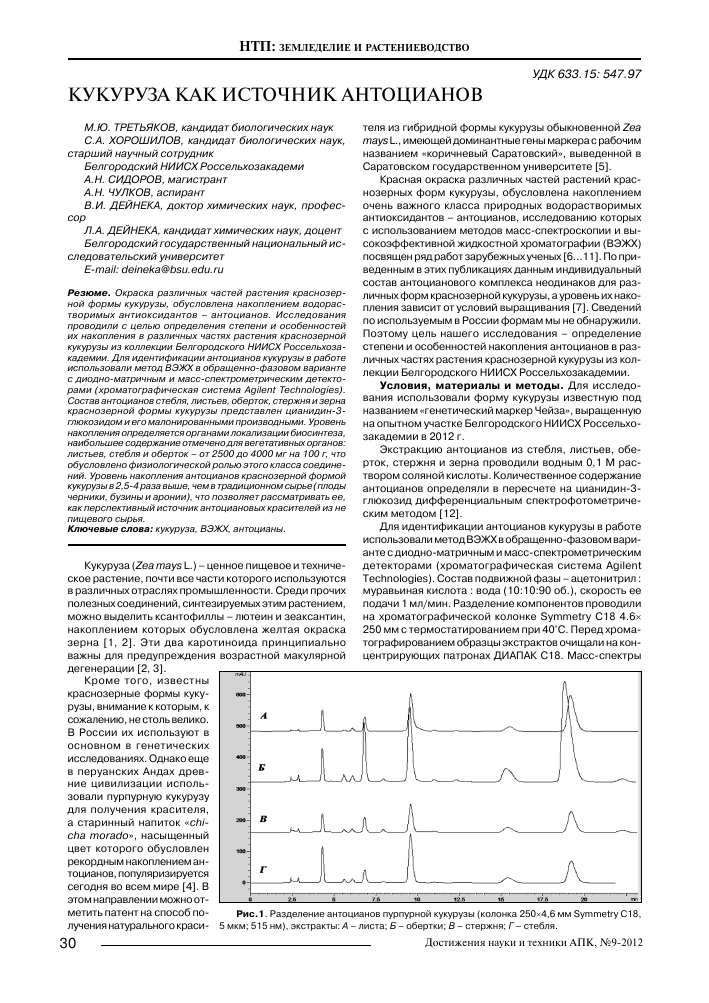
Рис.1. Разделение антоцианов пурпурной кукурузы (колонка 250x4,6 мм Symmetry C18, 5 мкм; 515 нм), экстракты: А - листа; Б - обертки; В - стержня; Г - стебля.
записывали на квадрупольном масс спектрометре Agilent 6130 LC/MS в режиме ESI (ионизация распылением в электрическом поле) с позитивным режимом сканирования в диапазоне масс 250...1200. Напряжение на фрагментаторе - 200 В, ток на короне - 4 мкА, давление газа-распылителя - 2 бар, скорость газа осушителя - 10 л/мин, температура газа осушителя -350°С, температура испарителя - 250°С.
Результаты и обсуждение. Состав антоцианов стебля, листьев, оберток, стержня и зерна краснозерной формы кукурузы, исследованной в нашей работе, принципиально одинаков с некоторыми качественными различиями (рис. 1).
Определение состава антоцианов путем сопоставления масс-спектров и электронных спектров в кювете диодно-матричного детектора (рис. 2, табл. 1) при записи хроматограммы на микроколонке свидетельствует об одинаковом наборе ферментов, отвечающих за вторичный метаболизм во всех тканях растения, проявляющих активность в биосинтезе антоцианов.
Как и в известных литературных источниках, основные компоненты антоцианового комплекса построены на цианидин-3-глюкозиде: активность флаваноид-3’-гидроксилазы, РЗ’И [13], высока во всех частях растений. По этой причине производные пеларгонидина обнаруживаются лишь в качестве минорных примесей. С другой стороны, высокой концентрации производных цианидина способствует и низкая активность метилтрансферазы - в продуктах накапливается также небольшое количество производных пеонидина (см. табл. 1).
Кроме того, для антоцианововых комплексов различных частей кукурузы характерна высокая активность малонил-трансферазы, отвечающей за долю ацилированных этой кислотой цианидин-3-глюкозидов (см. табл. 1). Множественное число в данном случае связано с тем, что в глюкозидном радикале имеется четыре гидроксильные группы, способные вступать в реакцию этерификации. Поэтому неудивительно, что на хроматограмме наблюдается именно четыре изомера моноацилированного цианидн-3-глюкозида, хотя в
цитированной ранее литературе обычно определяют только один - цианидин-3-(6’-малонилглюкозид). Из четырех изомеров в значительных количествах присутствую только два (пики 5 и 7 на хроматограмме на рис.2). При этом параметры спектров этих соединений близки, но не эквивалентны (см. табл. 1). Отсюда понятно, почему основной дималонированный продукт только один (пик № 14 на рис. 2). Любопытно, что ацилирование, приводящее к образованию пика 4, сопровождается небольшим гипсохромным (-0,3 нм) сдвигом максимума абсорбции, тогда как при ацили-ровании другого положения (пик 7) наблюдается уже батохромный (+0,5 нм) сдвиг; для дималонированного продукта (пик 14) справедлива практически аддитивная схема - наблюдается небольшой батохромный сдвиг (+0,5 -0,3 = +0,2 нм).
Наконец, нашими исследованиями подтверждена известная по литературным данным относительная лабильность малонированных антоцианов - их доля необычно быстро уменьшается при хранении экстрактов даже в бытовом холодильнике. Следовательно, корректный состав антоцианового комплекса можно определить только в свежеприготовленных экстрактах.
В количественном отношении - по уровню накопления антоцианов - дифференциация определяется органами локализации биосинтеза (табл. 2). Генеративный орган исследованной формы кукурузы - початок, включающий стержень и зерно содержит значительно меньше антоцианов. Наибольшее их накопление отмечено в вегетативных органах (листья, стебли и обертки), причем в стебле накопление идет по периферии (в эпидермисе). Такое распределение закономерно связано с физиологической ролью пигментов этого класса: защита фотосинтетического аппарата от фотоокислительного повреждения путем ослабления избыточной солнечной радиации [14].
Таблица 2. Содержание антоцианов в различных частях кукурузы Чейза*
Часть растения а**, мг на 100 г
Зерно 4 1+ 8
Стержень 127 ± 32
Обертки 2544 ± 386
Стебель 954 ± 60
Эпидермис стебля 2985±400
Листья 4140±500
* - урожай 2011 г.; ** - содержание антоцианов в пересчете на цианидин-3-глюкозид.
Выводы. Основные компоненты антоцианового комплекса формы кукурузы, известной под названием «генетический маркер Чейза», построены на цианидин-3-глюкозиде и его малонированных производных. Наиболее высокая степень накопления отмечена в обертках, листьях и эпидермисе стебля от 2500 до 4000 мг на 100 г. Поскольку в 100 г свежего
Таблица 1. Состав антоцианов в листьях краснозерной кукурузы
№* Название вещества tR, мин a**, моль % Каї нМ M/Z
1 Цианидин-3-глюкозид, C3G 7,29 8,4 515,5 287,0 449,1
2 Малонированный C3G, C3Gm 11,00 1,6 515,6 287,0 535,1
3 Пеларгонидин-3-глюкозид, Pg3G 11,54 0,5 503,0 271,1 433,1
4 Малонированный C3G, C3Gm 12,66 1,1 516,1 287,0 535,1
5 Малонированный C3G, C3Gm 14,89 2,2 515,2 287,0 535,1
6 Пеонидин-3-глюкозид, Pn3G 16,78 1,0 515,8 301,0 463,1
7 Малонированный C3G, C3Gm 24,18 33,7 516,0 287,0 535,1
8 Малонированный Pg3G, Pg3Gm 27,69 1,1 502,7 271,1 511,1
9 Дималонироованный C3G, C3Gmm 34,72 1,2 517,5 287,0 621,1
10 Малонированный Pn3G, Pn3Gm 42,16 0,7 520,1 301,0;549,1
11 Малонированный Pg3G, Pg3Gm 43,68 1,5 503,3 271,1 511,1
12 Дималонироованный C3G, C3Gmm 45,08 4,9 517,9 287,0; 621,1
13 Дималонироованный C3G, C3Gmm 48,10 3,1 515,9 287,0; 621,1
14 Дималонироованный C3G, C3Gmm 60,75 39,0 515,7 287,0; 621,1
* - номер пика на хроматограмме (рис. 2), ** - доля по площади пиков.
сырья самых богатых из природных источников (плоды дованная форма кукурузы - перспективный источник
черники, бузины и аронии) содержится порядка 1000 антоцианов, обеспечивающий получение колорантов
мг антоцианов [13], можно предположить, что иссле- из не пищевого сырья.
Литература.
1. Moreau R.A., Johnston D.B., Hicks K.B. A Comparison of the Levels of Lutein and Zeaxanthin in Corn Germ Oil, Corn Fiber Oil and Corn Kernel Oil// J. Am. Oil Chem. Soc. - 2007. - V.84. - P. 1039-1044.
2. Perry A., Rasmussen H., Johnson E.J. Xanthophyll (lutein, zeaxanthin) content in fruits, vegetables and corn and egg products // J. Food Composit. Anal. - 2009. - V.22.. - P. 9-15.
3. Krinsky N.I., Landrum J.T., Bone R.A. Biologic mechanisms of the protective role of lutein and zeaxanthin in the eye //Annu. Rev. Nutr. - 2003. - V.23. - P. 171-201.
4. Jones K. The potential benefits of purple corn // Herbal Gram. - 2005. - V.65. - P.46-49.
5. Усанов Д.А., Тырнов В.С., Вагарин А.Ю., Патент РФ 2158743. Способ получения антоцианового красителя из растительного сырья. Опубликовано 20.09.2010.
6. Abdel-aal El-S., Young J.C., Rabalski I. Anthocyanin Composition in Black, Blue, Pink, Purple, and Red Cereal Grains// J. Agric. Food Chem. - 2006. - V.54. - P. 4696-4704.
7. Jing P., Noriega V., Schwartz S.J., Giusti M.M. Effects of Growing Conditions on Purple Corncob (Zea mays L.) Anthocyanins// J. Agric. Food Chem. - 2007. - V.55. - P. 8625-8629.
8. Zhao X., Corrales M., Zhang C., Hu X., Ma Y., Tauscher B. Composition and Thermal Stability of Anthocyanins from Chinese Purple Corn (Zea mays L.)// J. Agric. Food Chem. - 2008. - V.56. - P. 10761-10766.
9. Pedreschi R., Cisneros-Zevallos L. Phenolic profiles of Andean purple corn (Zea mays L.) // Food Chem. - 2007. - V.100. -P. 956-963.
10. de Pascual-Teresa S., Santos-Buelga C., Rivas-Gonzalo J.C. LC-MS analysis of anthocyanins from purple corn cob // J. Sci. Food Agric. - 2002. - V.82. - P. 1003-1006.
11. Moreno Y.S., Sánchez G.S., Hernández D.R., Lobato N.R. Characterization of Anthocyanin Extracts from Maize Kernels // J. Chromatogr. Sci. - 2005. - V.43. - P. 483-487.
12. Giusti M.M., Wrolstad R.E. Characterization and Measurement of Anthocyanins by UV-Visible Spectroscopy// Current Protocols in Food Analytical Chemistry. John Wiley & Sons, Inc. 2001. - F1.2.1-F1.2.13.
13. Anthocyanins. Biosynthesis, Functions, and Applications. Ed.: Gould K., Davies K., Winefield C. Springer Science+Business Media, LLC. - 2009. - 332 p.
14. Соловченко А.Е., Чивкунова О.Б. Физиологическая роль накопления антоцианов в ювенильных листьях лещины // Физиология растений. М.: Наука Т.58, № 4, г.2011,С.582-589.
CORN AS A SOURCE OF ANTHOCYANIN M.Y. Tretyakov, S.A. Khoroshilov, A.N. Sidorov, A.N. Chulkov, V.I. Deineka, L.A. Deineka
Summary. Red color of different parts of the plant red grain corn form corn caused by the accumulation of water-soluble antioxidants - anthocyanins. The aim of the study was to determine the extent and characteristics of anthocyanin accumulation in different parts of the plant red grain corn collection of GNU Belgorod Agricultural Research Institute. For identification of anthocyanins in the corn used in the HPLC reversed-phase version with diode array and mass spectrometric detectors (chromatographic system Agilent Technologies). Anthocyanin composition of the stem, leaves, wraps, rod and red grain corn forms submitted cyanidin-3-glyukozidome malonirovannymi and its derivatives. The level of savings is determined by the localization of the biosynthesis of bodies, the greatest accumulation was observed for the vegetative organs of leaves, stem and wraps, from 2500 to 4000 mg per 100 g, which is due to the physiological role of this class of compounds. The level of accumulation of anthocyanins red grain corn form corn 2.5-4 times higher than the traditional raw material: fruits blueberry, elderberry and chokeberry - that allows us to consider it as a promising source of anthocyanin pigments from not eating raw. Key words: maize, HPLC, anthocyanins.
УДК 633.15:631.5
ТЕХНОЛОГИЧНОСТЬ ГИБРИДОВ КУКУРУЗЫ, КАК ЭЛЕМЕНТ СОВРЕМЕННЫХ АГРОТЕХНОЛОГИЙ
А.Н. ВОРОНИН, кандидат биологических наук, зав. лабораторией
С.А. ХОРОШИЛОВ, кандидат биологических наук, старший научный сотрудник Г.М. ЖУРБА, селекционер М.В. КЛИМЕНКО, научный сотрудник Л.Н. ШЕМЯКИНА, младший научный сотрудник Белгородский НИИСХ Россельхозакадемии E-mail: van959@mail.ru
Резюме. Представлены экспериментальные данные об элементах агротехнологии при выращивании кукурузы на зерно, основные из которых подбор адаптированных к условиям выращивания, высоко устойчивых к полеганию и ломкости стебля гибридов, оптимальная густота стояния растений,
определяющаяся скороспелостью гибрида и количеством осадков за вегетацию в регионе, рекомендованные дозы внесения азота (N90). Как элемент реализации потенциальной продуктивности гибрида и агроценоза в целом, в совокупности рассматриваются вопросы технологичности гибридов кукурузы, обусловленные устойчивостью растений к ломкости стебля и возможные пути создания таких форм. Оценка самоопыленныхлиний по ломкости стебля показала, что у БК 17-2 и БК 16-3 устойчивость превышает 90 % при абсолютной устойчивости к ломкости стебля ниже початка. Степень доминирования устойчивости к ломкости стебля составила от 13 до 53,8 %. Введение в генотип простого гибрида линий с высокой устойчивостью приводит к возрастанию устойчивости трехлинейных гибридов. Центральным звеном эффективной технологии должен выступать гибрид, адаптированный не только к почвенно-климатическим условиям конкретного региона, но и к главным элементам современных агротехнологий.





 CC BY
CC BY 194
194