АПОПТОЗ: СОВРЕМЕННЫЙ ВЗГЛЯД НА ПРОБЛЕМУ
С.Л. Стоян.
(Иркутский государственный медицинский университет, ректор - акад. МТА и АН ВШ д.м.н., проф. А.А. Майборода, кафедра педиатрии №2, зав. - проф. В.Г. Савватеева)
Резюме. В настоящем обзоре литературы представлены современные сведения о таком универсальном физиологическом процессе как апоптоз, обозначена природа апоптогенных сигналов и их рецепция, обсуждены внутриклеточные механизмы развития и основные морфологические проявления апоптоза.
Ключевые слова: апоптоз, научный обзор, внутриклеточные механизмы развития апоптоза, морфология апоптоза.
Современный этап развития медицинской науки характеризуется необходимостью изучения ведущих механизмов формирования патологических процессов уже не на организменном, органном или клеточном уровнях, а на молекулярном, что требует уточнения и конкретизации имеющихся знаний по вопросам фундаментальной медицины касательно универсальных физиологических и патофизиологических процессов. Одним из таких является феномен апоптоза.
Апоптоз (от греческого apoptosis - опадание листьев с деревьев) - это активный процесс реализации генетически запрограммированной гибели клетки, инициируемый действием различных факторов, не являющихся по своей природе деструктивными.
Впервые концепция апоптоза была выдвинута в работе J.E.R. Kerr и соавт. в 1972 году для обозначения "нормальной клеточной гибели при развитии тканей и их обновлении в зрелом организме" [14]. Принципиально важным в этом определении является указание на "нормальное" (физио-
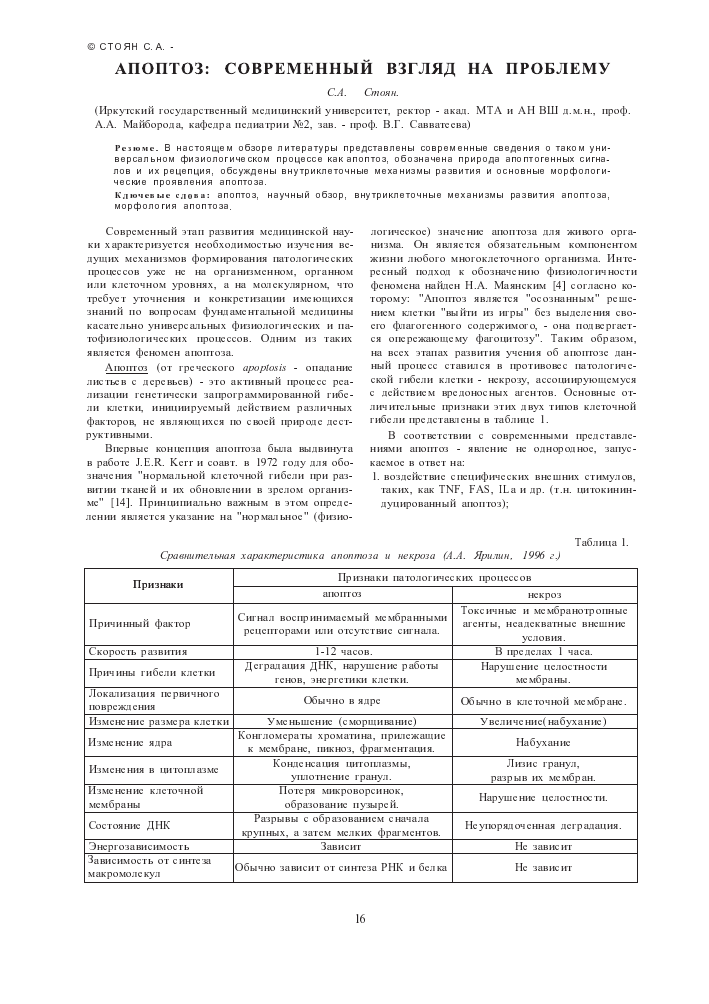
логическое) значение апоптоза для живого организма. Он является обязательным компонентом жизни любого многоклеточного организма. Интересный подход к обозначению физиологичности феномена найден Н.А. Маянским [4] согласно которому: "Апоптоз является "осознанным" решением клетки "выйти из игры" без выделения своего флагогенного содержимого, - она подвергается опережающему фагоцитозу". Таким образом, на всех этапах развития учения об апоптозе данный процесс ставился в противовес патологической гибели клетки - некрозу, ассоциирующемуся с действием вредоносных агентов. Основные отличительные признаки этих двух типов клеточной гибели представлены в таблице 1.
В соответствии с современными представлениями апоптоз - явление не однородное, запускаемое в ответ на:
1. воздействие специфических внешних стимулов, таких, как ТОТ, РАБ, 1Ьа и др. (т.н. цитокинин-дуцированный апоптоз);
Таблица 1.
Сравнительная характеристика апоптоза и некроза (Л.Л. Ярилин, 1996 г.)
Признаки Признаки патологических процессов
апоптоз некроз
Причинный фактор Сигнал воспринимаемый мембранными рецепторами или отсутствие сигнала. Токсичные и мембранотропные агенты, неадекватные внешние условия.
Скорость развития 1-12 часов. В пределах 1 часа.
Причины гибели клетки Деградация ДНК, нарушение работы генов, энергетики клетки. Нарушение целостности мембраны.
Локализация первичного повреждения Обычно в ядре Обычно в клеточной мембране.
Изменение размера клетки Уменьшение (сморщивание) Увеличение(набухание)
Изменение ядра Конгломераты хроматина, прилежащие к мембране, пикноз, фрагментация. Набухание
Изменения в цитоплазме Конденсация цитоплазмы, уплотнение гранул. Лизис гранул, разрыв их мембран.
Изменение клеточной мембраны Потеря микроворсинок, образование пузырей. Нарушение целостности.
Состояние ДНК Разрывы с образованием сначала крупных, а затем мелких фрагментов. Неупорядоченная деградация.
Энергозависимость Зависит Не зависит
Зависимость от синтеза макромолекул Обычно зависит от синтеза РНК и белка Не зависит
2. необратимое повреждение клеточных структур, не сопровождающееся нарушением целостности клеточных мембран (радиация, химиотерапия, токсическое воздействие);
3.воздействие внутриклеточных индукторов апоптоза (старение клетки);
4. отсутствие постоянного воздействия внешних антиапоптических стимулов [3,20].
Однако независимо от характеристик индукторных факторов все разновидности апоптоза имеют идентичные заключительные этапы развития и одинаковые морфологические проявления при незначительных различия'' инициальных процессов трансдукции сигнала.
Апоптичсскис изменения в клетке характеризуются определенной фазовостью течения. Согласно морфологическому делению выделяют две фазы:
1.фаза обратимых изменений, во время которой процесс апоптоза может быть остановлен и клеточные структуры, будут репарированы;
2. необратимая фаза, во время которой клеточные структуры разрушаются, и клетка формирует апоптическое тельце [3].
Тогда как физиологическая градация характеризует развитие апоптоза в три основные фазы:
1 .прсмитохондриальная фаза инициации, вызываемая различными факторами повреждения или рецепторно-лигандным взаимодействием;
2. митохондриальная эффскторная фаза с повреждением наружной и внутренней мембран митохондрий;
3.постмитохондриальная фаза деградации, во время которой апоптогенные факторы, вышедшие из интермембранного пространства митохондрий, активируют нуклеазы и протеазы [5].
Природа апоптогенных сигналов и их рецепции
На сегодняшний день общепринятым является мнение о том. что сигналы, инициирующие каскад реакций, конечным результирующим эффектом которых является апоптическая гибель клетки, могут быть чрезвычайно разнообразными (табл.2) [7.10.18].
Как следует из таблицы 2, большинство внешних сигналов, приводящих к развитию апоптоза, являются физиологическими, в связи с чем, по мнению ряда авторов [7] характер ответа клетки на внешнюю стимуляцию определяется не природой сигналов, а сопутствующими обстоятельствами (костимуляция или ее отсутствие) или же особенностями самих клеток (стадия дифференци-ровки, состояние системы репарации ДНК и пр.). Данное предположение не касается лишь одного из выше представленных индукторных факторов -Fas-лиганда (FasL). для которого пока не известны иные функции, чем индукция апоптоза (перекрестное сшивание специфичного ему FasR приводит к развитию апоптоза в клетке-мишени даже при отсутствии в ней ядра [5,19]).
FasL - это мембранный протеин II класса из семейства ФНО, мол. массой 36 кД [11], ген который картирован на 1 хромосоме. Экспрессируется Т-активированными лимфоцитами [1]. Мембраносвязанный FasL, подвергаясь расщеплению под воздействием специфической металлопротеиназы. освобождает растворимый цитокин [5]. Растворимая форма FasL существует в виде тримера и функциональна только у человека, тогда как у других животных не обладает медиаторной активностью [19].
Fas (АРО-1) - являясь проапоптическим рецептором (рецептор для FasL), принадлежит к мембранным белкам I типа и входит в состав семейства рецепторов ФНО (отличительная особенность FasR от других представителей семейства заключается в том, что он имеет 3 внеклеточных домена, тогда как упомянутые выше гомологи-4). Еен, кодирующий АРО-1, локализован на q 10 хромосоме (10q23). Цитоплазматический участок FasR именуется как death domain (DD). именно он ответственен за внутриклеточную передачу сигнала клеточной гибели [1,5,7.16].
Внутриклеточные механизмы развития апоптоза
При рассмотрении внутриклеточного каскада апоптического процесса необходимо сделать ряд допущений:
Таблица 2.
Происхождение и природа сигнала апоптической гибели клетки
Происхождение сигнала; отсутствие сигнала. Природа сигнала Примеры
Внеклеточные сигналы Антиген Еормон Цитокин или его аналог Отрицательная селекция тимоцитов, апоптоз при активации через TCR-CDЗ. Еибель клеток при действии глюкокортикоидов. РАБ-зависимый апоптоз; цитолиз, вызванный ФНО. лимфотоксином.
Внутриклеточный сигнал Повреждение хромосом Радиационная гибель лимфоцитов в интерфазе. Апоптоз при действии топоизомераз.
Дефицит сигнала Цитокин Корецептор Еибель кроветворных клеток при дефиците цито-кинов. Еибель активированных Т-гибридом в отсутствии ИЛ-2. Апоптоз активируемых Т-клеток в отсутствии С028- зависимого сигнала.
- на клетку не действуют внешние антиапоптичс-скис факторы;
- отсутствует генетическая блокировка апоптоза;
- репарационные процессы не активируются.
В результате взаимодействия индукторного фактора и специфичного ему рецептора перекрестная димеризация рецепторных частиц (Fas и TNF) не приводит к их активации как в случае с другими рецепторами. Доказано [17], что необходимым условием активации цитоплазматических доменов FasR и TNFR, и, следовательно, приобретение ими способности к дальнейшей трансдук-ции сигнала является тримеризация рецепторных субстанций.
Далее сигнал с мембранных рецепторов посредством протеиновых посредников (FADD для FasR и TRADD для TNFR), С-терминалы которых ассоциированы с death domain FasR и TNFR. трансформируется в сигнал активации молекулы СРР32 (каспаза 8), что запускает лавинообразную активацию каспазного каскада. На сегодняшний день известно 11 представителей семейства цис-теиновых протеаз, расщепляющих белки у остатка аспартата, в связи с чем они получили название каспазы (caspases - cystein aspases). К субстратам каспаз относятся белки цитоскелета (гельзолин, актин, фодрин) и скелетный белок ядра (ламин). Помимо этого каспазы обладают способностью к протеолизу ферментов репарации ДНК и к активации Ca,Mg-3aBiicnMoft эндонуклеазы [9].
Параллельно с инициацией каспазного каскада в клетке активируется целый ряд взаимосвязанных и взаимозависимых биохимических процессов, необходимых для апоптической гибели.
В частности, через рецептор-ассоциированные тирозинкиназы (семейство syk: ZAP-70) путем фосфорилирования активируется фосфолипаза С. которая, катализируя гидролиз фосфоинозитид-
4.5-дифосфата с образованием IP3 (инозитол-
1.4.5-трифосфата) и ДАГ (диацилглицерола), приводит к повышению цитозольной концентрации ионизированного Сал'. Эти вторичные посредники определяют изменение конформации Mg - связывающего белка Са-каналов (ДАГ - Са-каналов цитоплазматической мембраны, IP3 - мембраны эндоплазматического ретикулуума), в результате чего Mg освобождает канал - Са поступает в клетку [8]. Увеличение внутриклеточного содержания Са"" запускает в клетке многочисленные биохимические процессы, многие из которых необходимы для эффекторной фазы апоптоза (исключение составляет лишь Fas-индуцированный апоптоз, являющийся Са-независимым [15]). Так, повышение уровня ионизированного Са является обязательным условием для запуска кальциневри-нового и MAP-каскада активации клеток (через такие транскрипционные факторы как АР-1 и NF-АТ) [6]. Именно активация клеток с выходом в S-фазу в условиях повреждения ДНК и системы репарации ДНК определяет их гибель (задержка клеточных элементов в G-1 фазе отменяет апоптоз [7]).
Помимо этого нарастание концентрации Са необходимо для активации митохондрий, проте-азного каскада, лизосомальных ферментов, накопления нитрооксид и супероксид анионов, активации 1СЕ-протеаз.
Накопившиеся в клетке продукты распада, образующиеся в результате работы протеазного каскада, при условии высокого содержания в цитозоле ионов Са и воздействия каспазы-3, приводят к активации митохондрий и одновременному повреждению митохондриальной мембраны (что выражается в снижении трансмембранного потенциала delta psi М [2,15]). Дезинтеграция мембран активированных митохондрий приводит к высвобождению в клетку большого количества эффекторов апоптоза (голоцитохром С, AIF - apoptosis inducting factor), это определяет активацию АТФ-зависимого лизосомального комплекса: эндонуклеаз ICE, Mch-2, REL-II, REL-III и др. [13], а также коактивацию ферментов каспазного каскада, сопровождающуюся трансформацией pro-caspase 9 в активную форму - caspase 9. Активированные протеазы ICE начинают расщепление ядерной ДНК на фрагменты длиной по 50000 п.н., а в дальнейшем на более мелкие фрагменты длиной 180-200 п.н. с последующим разрушением мРНК [3].
Одновременно активированные лизосомаль-ные ферменты определяют протеолиз цитоплазматических белков, а каспазы - белков цитоскелета; развивающееся при этом снижение содержания белка в цитоплазме ведет к прогрессирующему уменьшению онкотического давления в клетке и депрессии значений pH с развитием клеточной дегидратации. Клетка уменьшается в размерах, -образуется апоптическое тельце.
Рассматривая биохимизм апоптоза, нельзя не упомянуть о процессе перестройки мембраны клетки с нарушением ее проницаемости, начинающемся еще в обратимую фазу. Данный процесс опосредован активацией фосфолипазы А2, спрингомиелазы и транслоказы фосфатидилсери-на, определяющей выход на наружную поверхность мембраны аннексин-У-распознаваемого фосфатидилсерина. Существует мнение [12], что экспрессированный на наружной поверхности мембраны фосфатидилсерин, являющийся одним из поверхностных маркеров апоптоза, распознается макрофагами и определяет исключительно высокую эффективность фагоцитоза апоптических тел.
Морфологические проявления апоптоза
Морфологически апоптоз характеризуется уменьшением размеров, сморщиванием клетки, уплотнением и фрагментацией хроматина. В ядре формируются осмиофильные скопления хроматина, обычно прилежащие к ядерной оболочке. Эти изменения служат самым ранним проявлением апоптоза, предшествующим процессам деградации. Затем в ядерной мембране образуются инвагинации, и хроматиновые фрагменты отшнуровы-ваются от ядра. Такие фрагменты, окруженные
мембраной, называют апоптичеекими тельцами. В цитоплазме происходят конденсация и сморщивание гранул без их разрушения, расширение эндо-плазматического ретикулума. Для апоптоза харак-
терны потеря клеточной мембраной микроворсинок и нормальной складчатости, отделение клетки от субстрата, формирование на ее поверхности пузырей.
APOPTOSIS: MODERN VIEW ON THE PROBLEM
S.A. Stoyan (Irkutsk State Medical University)
In the present review the modern data on such universal physiological process as apoptosis is presented, the nature of apoptogenous signals and their reception is designated, the intracellular mechanisms of development and basic morphological displays of apoptosis are discussed.
Литература
1. Барышников А.Ю., Полосухина E.P. Новый прогностический маркер острого лимфобластного лейкоза Fas/APO-І // Гематология и трансфузиоло-гия. - 1998. - №2. - С. 12-15.
2. Духанин А.С., Патрашев Д.В., Огурцов С.И. Изменение трансмембранного потенциала тимоцитов при дексаметазон- и Са- индуцированном апопто-зе // Экспериментальная и клиническая фармакология. - 1999. - Т.62, №3. - С.40-43.
3. Казначеев К.С. Механизмы развития цитокинин-дуцированного апоптоза // Гематология и трансфу-зиология. - 1999. - №1. - С.40-43.
4. Маянский А.Н., Маянский НА., Заславская М.И. и др. Апоптоз нейтрофилов // Иммунология. -
1999. - № 6. - С. 11-19.
5. Сепиашвили Р.И., Шубич М.Г., Колесникова Н.В. и др. // Апоптоз в иммунологических процессах. -
2000. - Т. 1, №1. - С. 15-23.
6. Талаев В.Ю. Внутриклеточные пути передачи сигналов у Т-лимфоцитов в норме и патологии // Иммунология. - 1999. - №6. - С.20-24.
7. Ярилин АА. Апоптоз и его место в иммунных процессах//Иммунология. - 1996. -№6. -С. 10-23.
8. Программированная клеточная гибель // Под. ред. А.Н. Новикова. - СПб., 1996 г.
9. Cohen J.J. // Sem. Immunology. - 1992. - Vol.4. -P.363-369.
10. Cohen G.M. // Biochem. J. - 1997. - Vol.326. - P.l-16.
11. I ton N.. Nagata S. // J. Biol. Chem. - 1993. -
Vol.268. - P. 10932-10938.
12. Fadok V.A.. Voelker D.R.. Campbell PA. et al. // J. Immunology. - 1992. - Vol. 148. - P.2207-2216.
13. Gerschenson L.E.. Rotello R.J. // FASEB J. - 1992. -Vol.6. - P.2450.
14. Kerr J.F.R.. Wyllie A.H.. Currie A.R. // Br. J. Cancer. - 1972. - Vol.26. - P.239-257.
15. Kromer G. // Cell Death Differentiation. - 1997. -Vol. 1. - P.450-456.
16. Nagata S„ Golstein P. // Scence. - 1995. - Vol.267. -P.1449-1456.
17. Nagata S. // Cell. - 1997. - Vol.88. - P.355-365.
18. Norvell A.. Mandik L.. Monroe J.G. // Ibid. - 1995. -Vol.154. - P.363-369.
19. Schuze-Osthoff K.. Walczak H.. Drode W. et al. // J. Cell Biol. - 1994. - Vol.127. -P. 15-20.
20. Whete E. // Genes Dev. - 1996. - Vol. 10. - P.l-15.





 CC BY
CC BY 280
280